「新型コロナワクチン承認審査・健康被害救済制度」を司るPMDA、そこを司るICH (医薬品規制調和国際会議)について
PMDA(独立行政法人医薬品医療機器総合機構)について
PMDAとは
独立行政法人医薬品医療機器総合機構(PMDA;Pharmaceuticals and Medical Devices Agency)は、2001年に閣議決定された特殊法人等整理合理化計画を受けて、国立医薬品食品衛生研究所医薬品医療機器審査センター、医薬品副作用被害救済・研究振興調査機構及び財団法人医療機器センターの一部の業務を統合し、独立行政法人医薬品医療機器総合機構法に基づいて2004年4月1日に設立され、業務を開始しました。
PMDAは、医薬品の副作用や生物由来製品を介した感染等による健康被害に対して、迅速な救済を図り(健康被害救済)、医薬品や医療機器などの品質、有効性および安全性について、治験前から承認までを一貫した体制で指導・審査し(承認審査)、市販後における安全性に関する情報の収集、分析、提供を行う(安全対策)ことを通じて、国民保健の向上に貢献することを目的としています。
PMDAの果たす3つの役割
セイフティ・トライアングル
3つの業務による総合的なリスクマネジメント
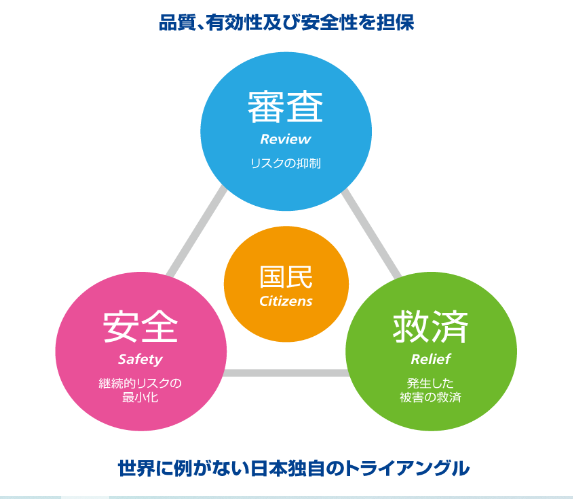
PMDAは、医薬品などの健康被害救済、承認審査、安全対策の3つの役割を一体として行う世界で唯一の公的機関として、レギュラトリーサイエンスに基づき、より安全でより品質のよい製品をより早く医療現場に届け、医療水準の向上に貢献しています。
出典:PMDA 承認審査業務
医薬品等承認審査業務
医薬品の承認審査では、薬学、医学、獣医学、理学、生物統計学などの専門知識を有する審査員が、「品質」「薬理」「薬物動態」「毒性」「臨床」「生物統計」を担当し、審査チームを形成して審査を行います。また、審査の過程では、外部専門家との意見交換(専門協議)を行い、より専門性の高い見地から審査することを目指しています。
また、より優れた医薬品をより早く医療現場に提供するため、審査期間の目標を設定し、業務の迅速化に取り組んでいます。
さらに、日本、アメリカ、ヨーロッパにおける新医薬品の承認審査資料関連規制の整合化を図ることにより、データの国際的な相互受け入れを実現することを目的とした医薬品規制調和国際会議(ICH)に参加するとともに、同会議で合意された内容を積極的に承認審査に取り入れています。
PMDAの連携機関「ICH」について
医薬品規制調和国際会議(ICH)とは
ICHとは、医薬品規制調和国際会議の略称で、世界各国の医薬品規制当局や製薬業界の代表者が集まり、薬事規制に関するガイドラインを作成する国際会議。2015年、スイス法に基づき国際的な非営利法人となった。正式名称はInternational Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use。定期的に会合を開き、薬事規制の国際調和を推進するため、医薬品の承認審査や市販後安全対策などに関するガイドラインを作成している。
■ICHのメンバー
日本、米国、EU、スイス、カナダの規制当局と日本、米国、EUの製薬業界団体を中心に構成。2019年11月時点で16団体がメンバーとして参加している。
- 創設規制当局メンバー
- 厚生労働省/医薬品医療機器総合機構(MHLW/PMDA)
- 米国食品医薬品局(FDA)
- 欧州委員会/欧州医薬品庁(EC/EMA)
- 創設産業界メンバー
- 日本医薬工業協会(JPMA)
- 米国研究製薬工業協会(PhRMA)
- 欧州製薬団体連合会(EFPIA)
- 常任規制当局メンバー
- ヘルスカナダ
- スイスメディック
- 規制当局メンバー
- ブラジル国家衛生監督庁(ANVISA)
- 中国国家医薬品監督管理局(NMPA)
- シンガポール保健科学庁(HAS)
- 韓国食品医薬品安全処(MFDS)
- 台湾食品薬物管理署(TFDA)
- 産業界メンバー
- バイオテクノロジーイノベーション協会(BIO)
- 国際ジェネリック・バイオシミラー医薬品協会(IGBA)
- 世界セルフケア連盟(GSCF)
■ICHのオブザーバー
決定権や議決権を持たないオブザーバーとして、世界保健機関(WHO)、国際製薬団体連合会(IFPMA)など32団体が参加(2019年11月時点)している。
■ICHの目的
医薬品の承認審査や市販後安全対策などに関するガイドラインを作成し、薬事規制の国際調和を推進するのが目的。それによって以下のようなことを目指している。
・不必要な臨床試験の重複を減らすこと
・資源を節減し、安全性・有効性・品質の高い新薬の開発・上市を促進すること
・患者が継続的に新しい治療を利用できるようにすること
・安全性・有効性のない、不必要な動物試験を減少させること
など
(2020年1月11日内容更新)
(転載終了)